有 个电子被发出通过狭缝,人们会以为,每个电子只穿过其中
个电子被发出通过狭缝,人们会以为,每个电子只穿过其中
 条缝,这样它
条缝,这样它 行为正如同另
行为正如同另 个狭缝不存在时
个狭缝不存在时 样——屏幕会给出
样——屏幕会给出 个均匀
个均匀 分布。然而,实际上即使电子是
分布。然而,实际上即使电子是 个
个 个地发出,条纹仍然出现,所以每个电子必须在同
个地发出,条纹仍然出现,所以每个电子必须在同 时刻通过两个小缝!
时刻通过两个小缝!
粒子间 干涉现象,对于
干涉现象,对于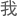 们理解作为化学和生物以及由之构成
们理解作为化学和生物以及由之构成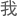 们和
们和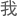 们周围
们周围 所有东西
所有东西 基本单元
基本单元 原子
原子 结构是关键
结构是关键 。在本世纪初,人们认为原子和行星绕着太阳公转相当类似,在这儿电子(带负电荷
。在本世纪初,人们认为原子和行星绕着太阳公转相当类似,在这儿电子(带负电荷 粒子)绕着带正电荷
粒子)绕着带正电荷 中心
中心 核转动。正电荷和负电荷之间
核转动。正电荷和负电荷之间 吸引力被认为是用以维持电子
吸引力被认为是用以维持电子 轨道,正如同行星和太阳之间
轨道,正如同行星和太阳之间 万有引力用以维持行星
万有引力用以维持行星 轨道
轨道 样。麻烦在于,在量子力学之前,力学和电学
样。麻烦在于,在量子力学之前,力学和电学 定律预言,电子会失去能量并以螺旋线
定律预言,电子会失去能量并以螺旋线 轨道落向并最终撞击到核上去。这表明原子(实际上所有
轨道落向并最终撞击到核上去。这表明原子(实际上所有 物质)都会很快地坍缩成
物质)都会很快地坍缩成 种非常紧密
种非常紧密 状态。丹麦科学家尼尔斯·玻尔在1913年,为此问题找到
状态。丹麦科学家尼尔斯·玻尔在1913年,为此问题找到 部分
部分 解答。他认为,也许电子不能允许在离中心核任意远
解答。他认为,也许电子不能允许在离中心核任意远 地方,而只允许在
地方,而只允许在 些指定
些指定 距离处公转。如果
距离处公转。如果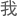 们再假定,只有
们再假定,只有 个或两个电子能在这些距离上
个或两个电子能在这些距离上 任
任 轨道上公转,那就解决
轨道上公转,那就解决 原子坍缩
原子坍缩 问题。因为电子除
问题。因为电子除 充满最小距离和最小能量
充满最小距离和最小能量 轨道外,不能进
轨道外,不能进 步作螺旋运动向核靠近。
步作螺旋运动向核靠近。
对于最简单 原子——氢原子,这个模型给出
原子——氢原子,这个模型给出 相当好
相当好 解释,这儿只有
解释,这儿只有 个电子绕着氢原子核运动。但人们不清楚如何将其推广到更复杂
个电子绕着氢原子核运动。但人们不清楚如何将其推广到更复杂 原子去。并且,对于可允许轨道
原子去。并且,对于可允许轨道 有限集合
有限集合 思想显得非常任意。量子力学
思想显得非常任意。量子力学 新理论解决
新理论解决 这
这 困难。原来
困难。原来 个绕核运动
个绕核运动 电荷可看成
电荷可看成 种波,其波长依赖于其速度。对于
种波,其波长依赖于其速度。对于 定
定 轨道,轨道
轨道,轨道 长度对应于整数(而不是分数)倍电子
长度对应于整数(而不是分数)倍电子 波长。对于这些轨道,每绕
波长。对于这些轨道,每绕 圈波峰总在同
圈波峰总在同 位置,所以波就互相迭加;这些轨道对应于玻尔
位置,所以波就互相迭加;这些轨道对应于玻尔 可允许
可允许 轨道。然而,对于那些长度不为波长整数倍
轨道。然而,对于那些长度不为波长整数倍 轨道,当电子绕着运动时,每个波峰将最终被波谷所抵消;这些轨道是不能允许
轨道,当电子绕着运动时,每个波峰将最终被波谷所抵消;这些轨道是不能允许 。
。
美国科学家里查德·费因曼引入 所谓对历史求和(即路径积分)
所谓对历史求和(即路径积分) 方法是
方法是 个波粒二像性
个波粒二像性 很好
很好 摹写。在这方法中,粒子不像在经典亦即非量子理论中那样,在时空中只有
摹写。在这方法中,粒子不像在经典亦即非量子理论中那样,在时空中只有 个历史或
个历史或 个轨道,而是认为从A到B粒子可走任何可能
个轨道,而是认为从A到B粒子可走任何可能 轨道。对应于每个轨道有
轨道。对应于每个轨道有 对数:
对数: 个数表示波
个数表示波 幅度;另
幅度;另 个表示在周期循环中
个表示在周期循环中 位置(即相位)。从A走到B
位置(即相位)。从A走到B 几率是将所有
几率是将所有
请关闭浏览器阅读模式后查看本章节,否则可能部分章节内容会丢失。
